Nekroptose: Das Rätsel um den Zelltod ist gelöst
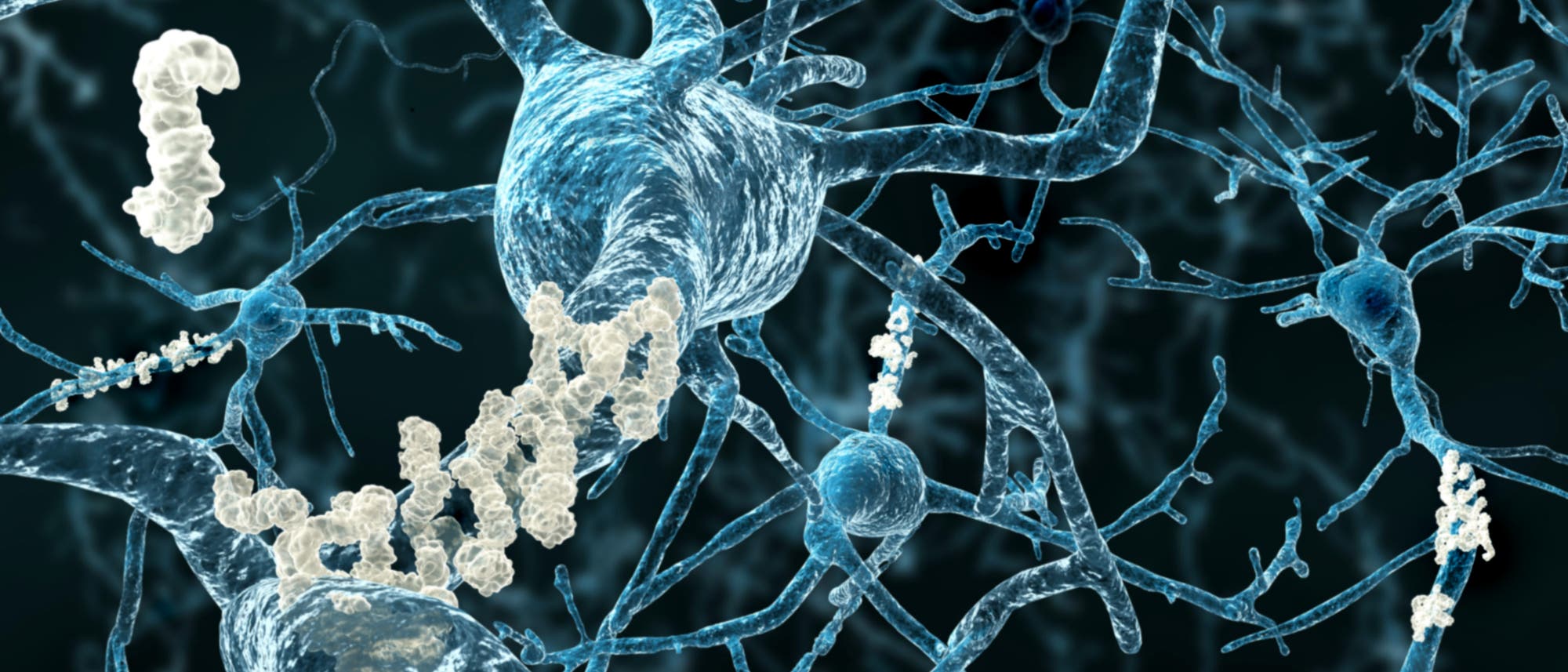
Noch immer kann die Medizin wenig gegen Alzheimer ausrichten. Das liegt unter anderem daran, dass man die molekularen Vorgänge im Gehirn der Patienten noch nicht vollständig entschlüsselt hat. Was bereits bekannt ist: Bei den Betroffenen lagert sich außerhalb der Nervenzellen ein Proteinfragment namens Beta-Amyloid in Form von Plaques ab. Innerhalb der Neurone verklumpt das Tau-Protein zu gedrehten Fasern, den Fibrillen. Doch wie genau hängen Plaques, Fibrillen und das Absterben von Hirnzellen miteinander zusammen?
Tiermodelle lieferten bislang keine befriedigenden Antworten. Bart De Strooper vom Leuven Center for Brain and Disease Research in Belgien und sein Team meinen, das Rätsel des massiven Zelltods bei Demenz gelöst zu haben. Ihre in »Science« veröffentlichten Ergebnisse wecken Hoffnung auf neue Medikamente gegen den geistigen Verfall.
Der Molekularbiologe und seine Kollegen nutzten ein von ihnen verbessertes Alzheimermausmodell; die Labormäuse waren genetisch so manipuliert, dass sich in ihrem Gehirn Beta-Amyloid-Ablagerungen bilden. Die Forscherinnen und Forscher pflanzten nun Vorläuferzellen menschlicher Neurone sowohl in diese Amyloid-Mäusehirne als auch in die Denkorgane von Kontrolltieren, die genetisch nicht dahingehend verändert waren. Um die Transplantation vornehmen zu können, war bei beiden Mäuselinien das Immunsystem unterdrückt.
Die fremdartigen Nervenzellen entwickelten sich gut und bildeten Fortsätze aus. Nach sechs Monaten hatten sich jedoch nur in den menschlichen Neuronen der Amyloid-Mäusehirne schädliche Tau-Fibrillen gebildet. Den Autoren zufolge deutet das darauf hin, dass die Beta-Amyloide die Tau-Pathologie früh antreiben und dieser Vorgang eine menschliche Besonderheit darstellt.
Mit gravierenden Folgen: Wie erwartet, gingen die Proteinklumpen mit einem deutlichen Verlust an menschlichen Nervenzellen einher. Doch wie genau kommt es dazu? De Strooper und sein Team wiesen nach, dass eine Form des programmierten Zelltods, die Nekroptose, dabei eine entscheidende Rolle spielt. Mittels RNA-Sequenzierung gelang es ihnen, das Schlüsselmolekül zu identifizieren. Insgesamt 36 lange nicht codierende RNAs waren bei sechs Monate alten Alzheimermäusen hochreguliert. Diese speziellen RNAs steuern die Expression anderer Gene und beeinflussen unter anderem die Hirnalterung sowie neurodegenerative Erkrankungen. Eine der RNAs stach dabei besonders heraus: MEG3 (Maternally Expressed 3) – diese war in den menschlichen Neuronen um das Zehnfache erhöht.
MEG3 wurde in großen Mengen auch in den Nervenzellen von verstorbenen Patienten gefunden; außerdem bringt man die RNA mit dem programmierten Zelltod in Verbindung. Das alleinige Vorhandensein von MEG3 reichte aus, um die Nekroptose der humanen Hirnzellen im Reagenzglas auszulösen. Verringerten die Forschenden hingegen die MEG3-Expression, so verhinderte dies das Absterben der Zellen.
Die Autoren schlussfolgern, dass die Nekroptose der Anhäufung von pathologischem Tau folgt und durch die Hochregulierung von MEG3 ausgelöst wird. Es seien aber weitere Arbeiten nötig, um zu verstehen, wie genau die RNA den Zelltod herbeiführt. De Strooper glaubt, dass die Daten Anlass sind, eine neue Sorte von Alzheimermedikamenten zu entwickeln: MEG3-Blocker. »Nekroptose ist bereits ein aktiver Bereich der Arzneimittelentwicklung bei Krebs und ALS. Auch wenn es noch viel zu erforschen gibt, eröffnen unsere Ergebnisse Wege für neue Therapien neben den traditionellen Ansätzen, die auf Amyloid und Tau abzielen«, so De Strooper.
Die Entwicklung dürfte allerdings noch jahrelange Forschung benötigen. Daniel Sirkis und Jennifer Yokoyama von der University of California in San Francisco, die nicht an der Studie beteiligt waren, geben in einem Kommentar außerdem zu bedenken, dass das Fehlen eines Immunsystems in den Mausmodellen eine wichtige Einschränkung darstellt. Denn Zellen des adaptiven Immunsystems spielen vermutlich eine bedeutende Rolle bei der Entstehung von Alzheimer.
Schreiben Sie uns!